الغليان وحرارة التبخير
من المعلوم أن جزيئات السائل تؤثر على بعضها البعض بقوى تجاذبية متبادلة قوية لـ حد ما. (قوى التجاذب ذات طبيعة كهربائية اساساً ). وإذا نظرنا غلى الجزيئات الموجودة على سطح السائل سنجد ان الغالبية العظمى منها لا تستطيع الهرب لـ المنطقة التي تقع خارج السطح. ولكن، كما في حالة الغازات، يحدث أن يكتسب القليل من هذه الجزيئات طاقة واسعة جداً بسبب الحركة الحرارية. ونتيجة لذلك يمكن أن تهرب مثل هذه الجزيئات من سطح السائل متحولة بذلك من الحالة السائلة لـ الحالة الغازية، وتسمى هذه المهمة بالتبخير أو التصعيد.
ونظراً لأن أعلى الجزيئات طاقة هي وحدها التي تهرب من السطح، فإن ذلك يؤدي لـ نقص متوسط طاقة الجزيئات المتبقية مع استمرار عملية التبخر. ومن ثم فإن درجة حرارة السائل المعزول يجب ان تقل نتيجة للتبخر؛ وذلك لأن درجة الحرارة، كما نعلم، مقياس لطاقة حركة الجزيئات. وهكذا نكون قد وصلنا لـ تفسير هذه الحقيقة المعروفة بان التبخر يسبب تبريداً للسائل.
بناء على ذلك يمكن القول أنه إذا أريد لجزيئات السائل أن تهرب من سطح السائل فإن من الضروري تزويدها بالطاقة اللازمة. وتعرف كمية الطاقة اللازمة لذلك ، والتي تختلق من مادة لـ أخرى، باسم حرارة التبخير، وتعريفها كالتالي:
تسمى الطاقة اللازمة لتحويل وحدة الكتلة من المادة من الطور السائل لـ الطور البخاري ( الغازي) بحرارة تبخير (Hv) هذه المادة.
(1) Q = mHv
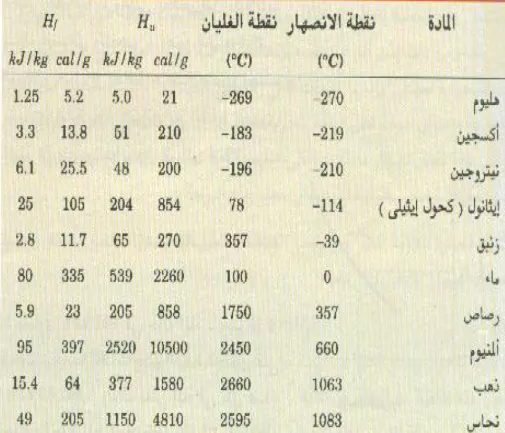
وعندما تتكثف وحدة الكتلة من المادة من الطور البخاري لـ الطور السائل سوف تنطلق نفس هذه الكمية من الطاقة من المادة؛ ويوضح الجدول 1)) قيم Hv لبعض المواد المألوفة.
الجدول 1)) حرارة التبخير وحرارة الانصهار لبعض المواد المألوفة

يغلي السائل عندما تتكون الفقاعات البخارية وتنمو داخله. ولكي يمكننا فهم ما يحدث في هذه المهمة يجب ان نفهم اولاً ما هو ضغط البخار. لفرض أن دلينا سائلاً وبخاره في إناء مغلق كالمبين بالشكل 1)). في مثل هذا الموقف يتحقق الاتزان بين السائل وبخاره عندما يتزن عدد الجزيئات المتبخرة من السائل مع عدد الجزيئات المتكثفة من البخار لـ السائل. ويسمى ضغط بخار السائل في حالة الاتزان هذه بضغط البخار ( أو الضغط البخاري) للسائل. وبالطبع فإن ضغط البخار يزداد بزيادة درجة الحرارة. لماذا ؟